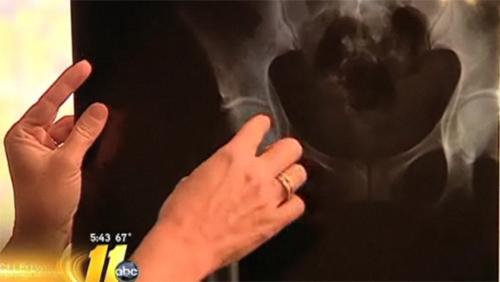
 Incluso después de un año cargado de retiradas de productos médicos, las empresas de dispositivos médicos han arreciado sus críticas a la normativa gubernamental y tratan activamente de socavar los esfuerzos por fabricar productos más seguros. La semana pasada, por ejemplo, el New York Times mencionó Implantes de cadera defectuosos de DePuy en un artículo sobre empresas que diga las normas de seguridad enviará negocios al extranjero. Pero un estudio publicado esta semana ha demostrado que la Administración de Alimentos y Medicamentos utilizó un proceso de aprobación abreviado más del 70% de los productos retirados en los últimos cinco años. Por una buena razón, es probable que este estudio frustre cualquier esperanza de que disminuya el escrutinio de la FDA.
Incluso después de un año cargado de retiradas de productos médicos, las empresas de dispositivos médicos han arreciado sus críticas a la normativa gubernamental y tratan activamente de socavar los esfuerzos por fabricar productos más seguros. La semana pasada, por ejemplo, el New York Times mencionó Implantes de cadera defectuosos de DePuy en un artículo sobre empresas que diga las normas de seguridad enviará negocios al extranjero. Pero un estudio publicado esta semana ha demostrado que la Administración de Alimentos y Medicamentos utilizó un proceso de aprobación abreviado más del 70% de los productos retirados en los últimos cinco años. Por una buena razón, es probable que este estudio frustre cualquier esperanza de que disminuya el escrutinio de la FDA.
El proceso de aprobación en cuestión permite que un nuevo producto se someta a una revisión de seguridad abreviada si se demuestra que es similar a otro producto ya comercializado. Los implantes de cadera de DePuy, por ejemplo, eran similares al modelo Ultima, que había sido aprobado años antes, y por tanto pudieron pasar sin problemas el proceso de aprobación de la FDA. Al parecer, no fue tan buena idea, ya que el estudio Archives of Internal Medicine descubrió que el 70% de los 113 dispositivos retirados del mercado en los últimos cinco años formaban parte de la revisión más corta. Diana Zuckerman, una de las coautoras del estudio, afirma que si la normativa no se refuerza, cabe esperar que se produzcan aún más retiradas: "La ley se ha ido haciendo cada vez más laxa con el tiempo".
En su mayor parte, la FDA se ha mantenido a la defensiva. "Incluso una retirada es demasiado", declaró la portavoz Karen Riley al Washington Post. "Pero teniendo en cuenta que entre 2005 y 2009 se autorizaron más de 19.000 dispositivos a través de este proceso, es importante relativizar las 80 retiradas. Representan un pequeño número de los dispositivos autorizados a través del programa y no reflejan los miles de personas que se han beneficiado de estos dispositivos." Pero este argumento cayó por su propio peso ante el cardiólogo y coautor del estudio, el Dr. Steven E. Nissen, quien dijo simplemente que "ésta es un área en la que la FDA ha fallado al público".
Es probable que las demandas contra DePuy no arrecien hasta dentro de unos meses o incluso años. Pero mientras tanto, periodistas y científicos seguirán publicando información sobre los implantes de cadera de DePuy que arrojará luz sobre la cuestión de si la filial de Johnson & Johnson introdujo precipitadamente en el mercado un producto de implante de cadera peligroso. Le mantendremos informado.



 AI-búsqueda
AI-búsqueda  Correo electrónico
Correo electrónico